Ralf Gilsbach et al.: Dynamic DNA methylation orchestrates cardiomyocyte development, maturation and disease. Nature Communications 5, 22.10.2014, doi: 10.1038/ncomms6288.
Ein Team von Epigenetikern aus verschiedenen Instituten im Raum Freiburg/Basel hat sich die systematische Erforschung epigenetischer Markierungen von Herzmuskelzellen vorgenommen und nun erste interessante Resultate veröffentlicht. Der Vergleich der sehr genau erfassten Epigenome aus Zellkernen der Herzen von neugeborenen Mäusen, gesunden ausgewachsenen Tieren und solchen mit einer Herzinsuffizienz beleuchtet die entscheidenden epigenetischen Schritte auf dem Weg von der Reifung und dem Wachstum hin zum fertigen Herzen und weiter zum erkrankten Organ. Am Anfang steht dabei eine zunehmende Demethylierung der Gene, das heißt, es werden Methylgruppen von der DNA entfernt und damit Gene aktivierbar gemacht, die die Reifung der Zellen steuern.
Erkrankt das Herz, werden diese Gene wieder zunehmend stumm geschaltet. Das geschieht entweder, indem erneut Methylgruppen angelagert werden oder indem Enzyme binden, die den Histon-Code der Zellen verstellen. Epigenetisch erinnern die Zellen dann wieder an jene Neugeborener. Die Forscher um Ralf Gilsbach und Lutz Hein von der Universität Freiburg hoffen nun auf neue Erkenntnisse, wie angeborene Herzfehler oder chronische Herzschwäche entstehen und was man vielleicht eines Tages gegen diese Leiden unternehmen kann.
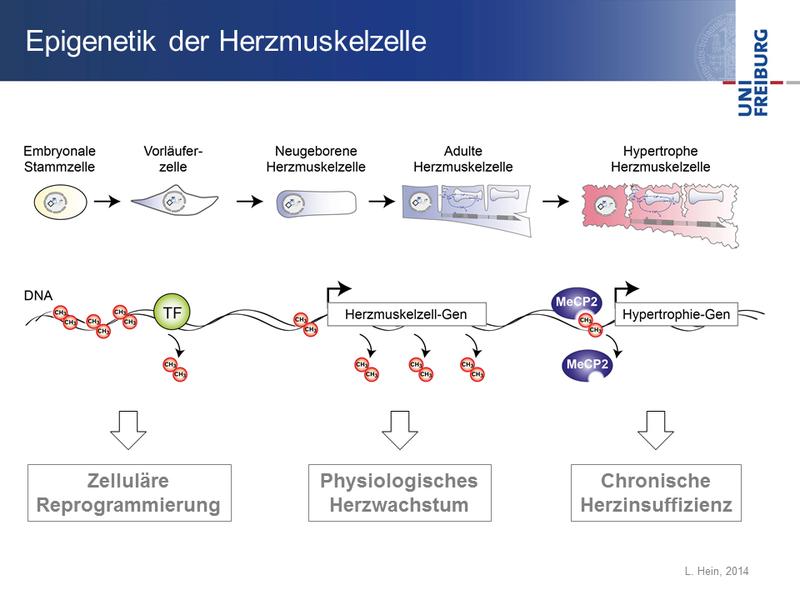 Grafik: Während der Entwicklung aus Stamm- und Vorläuferzellen durchlaufen Herzmuskelzellen einen Reifungsprozess (obere Reihe), der von epigenetischen Markierungen gesteuert wird (untere Reihe). Zunächst werden Methylgruppen (CH-3) von der DNA entfernt. Dadurch erhalten Transkriptionsfaktoren (TF) Zugang zur DNA und können Gene aktivieren. Bei einer Herzinsuffizienz wird das pathologische Wachstum durch Proteine gesteuert, die an die DNA-Methylierung binden und stumm geschaltete Gene aktivieren können (zum Beispiel MeCP2). (Lutz Hein, Universität Freiburg)
Grafik: Während der Entwicklung aus Stamm- und Vorläuferzellen durchlaufen Herzmuskelzellen einen Reifungsprozess (obere Reihe), der von epigenetischen Markierungen gesteuert wird (untere Reihe). Zunächst werden Methylgruppen (CH-3) von der DNA entfernt. Dadurch erhalten Transkriptionsfaktoren (TF) Zugang zur DNA und können Gene aktivieren. Bei einer Herzinsuffizienz wird das pathologische Wachstum durch Proteine gesteuert, die an die DNA-Methylierung binden und stumm geschaltete Gene aktivieren können (zum Beispiel MeCP2). (Lutz Hein, Universität Freiburg)