In den letzten Jahren hat die Lichtmikroskopie große Fortschritte gemacht, was in der Verleihung des Nobelpreises für Chemie im Jahr 2014 für die Technik der superauflösenden Fluoreszenzmikroskopie gipfelte (an Eric Betzig, William E. Moerner und Stefan Hell). Jetzt haben Forscher vom Institut für Molekularbiologie (IMB) in Mainz eine moderne Variante dieser Technik benutzt (single molecule localization microscopy; SMLM), um dem Chromatin genannten DNA-Protein-Gemisch, aus dem das Erbgut unserer Zellen besteht, direkt bei der Arbeit zuzuschauen. Es gelangen ungeahnt detaillierte Einblicke, neue Erkenntnisse und wunderschöne Bilder.
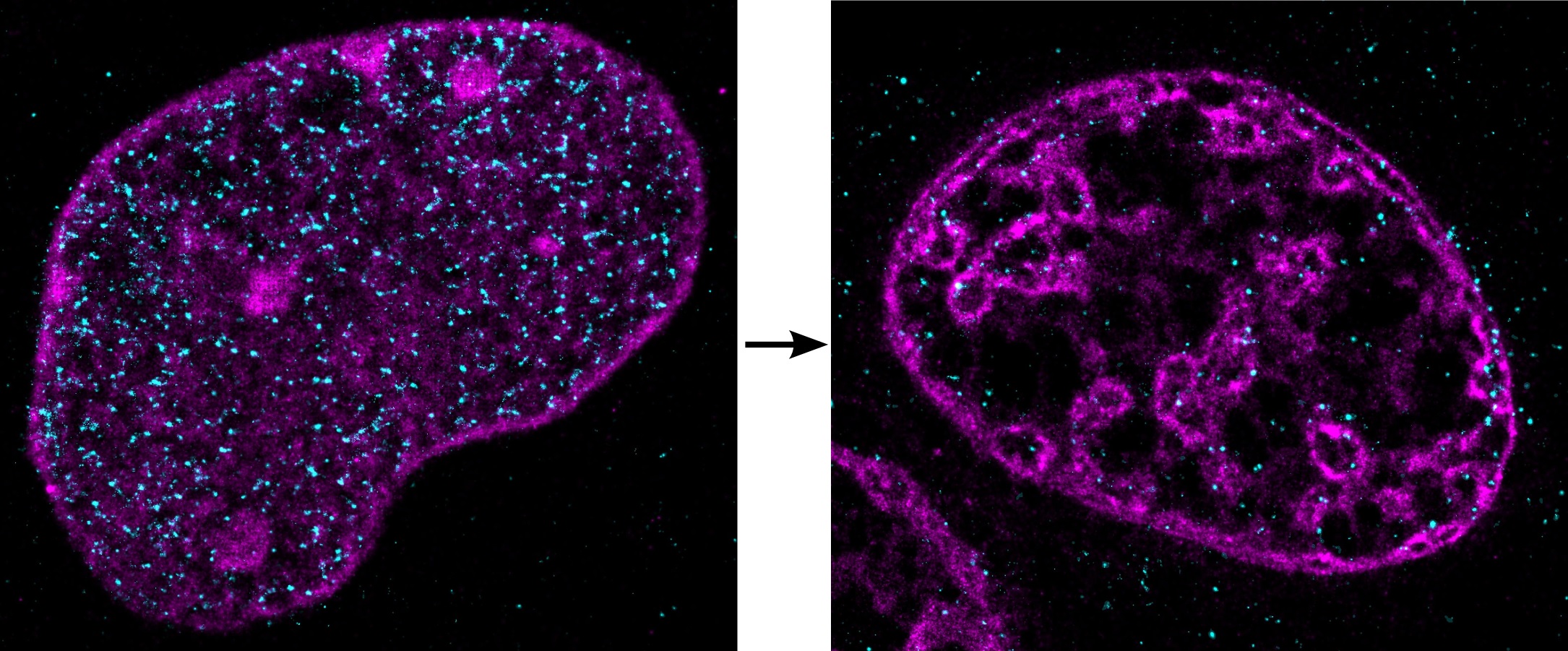
Foto: DNA in einem Zellkern unter normalen (links) und ischämischen Bedingungen (rechts) (Bildrechte: A. Szczurek & I. Kirmes).
Ina Kirmes und Kollegen setzten Herzmuskelzellen unter Hungerstress, das heißt, sie raubten ihnen die Zufuhr von Nährstoffen und Sauerstoff. In einer ähnlichen Situation befinden sich Herzmuskelzellen oder Gehirnzellen, wenn nach einem Herzinfarkt oder Schlaganfall die Blutzufuhr unterbunden ist. Man weiß, dass diese Mangelversorgung (Ischämie) bleibende Schäden bis hin zum Absterben des Gewebes haben kann – der Grund, warum Herzinfarkte und Schlaganfälle so gefährlich sind. Die Mainzer Forscher beobachteten jetzt, dass schon kurz nach Einsetzen des Mangels eine dramatische Veränderung der Epigenetik in den Zellen einsetzt.
Zu Beginn des Experiments waren die Zellen normal aktiv. Der größte Teil des Chromatins lag in der offenen, frei zugänglichen Form vor, in der möglichst viele Gene aktivierbar sind (Euchromatin). Wurden Sauerstoff und Nährstoffe reduziert, veränderten Enzyme offenbar die Histonproteine, um die die DNA aufgewickelt ist. Das fadenartig dünne Chromatin-Durcheinander schnurrte zu wenigen ungewöhnlich dichten Strukturen zusammen, die die Wissenschaftler entfernt an Atolle in der Südsee erinnerten (Foto rechts, zum Vergrößern anklicken). Als Folge waren die meisten Gene inaktiv.
Dieser Chromatin-Zustand wurde bislang noch nie beschrieben, und er scheint direkt mit dem Hungerstress zusammenzuhängen. Denn sobald die Forscher die Zellen wieder ausreichend versorgten, entfaltete sich das Chromatin sogar noch weiter als zuvor. Zudem waren noch mehr Gene aktiv – vermutlich eine Überkompensation. Kirmes und Kollegen bemerken, die Chromatinstruktur von Zellen reagiere erstaunlich rasch auf Umwelteinflüsse. Das sei eine gute Nachricht, denn es eröffne Möglichkeiten der medizinischen Intervention. „Da wir jetzt wissen, was geschieht, können wir nach Wegen suchen, dieser Verdichtung der DNA vorzubeugen“, sagt Arbeitsgruppenleiter George Reid.